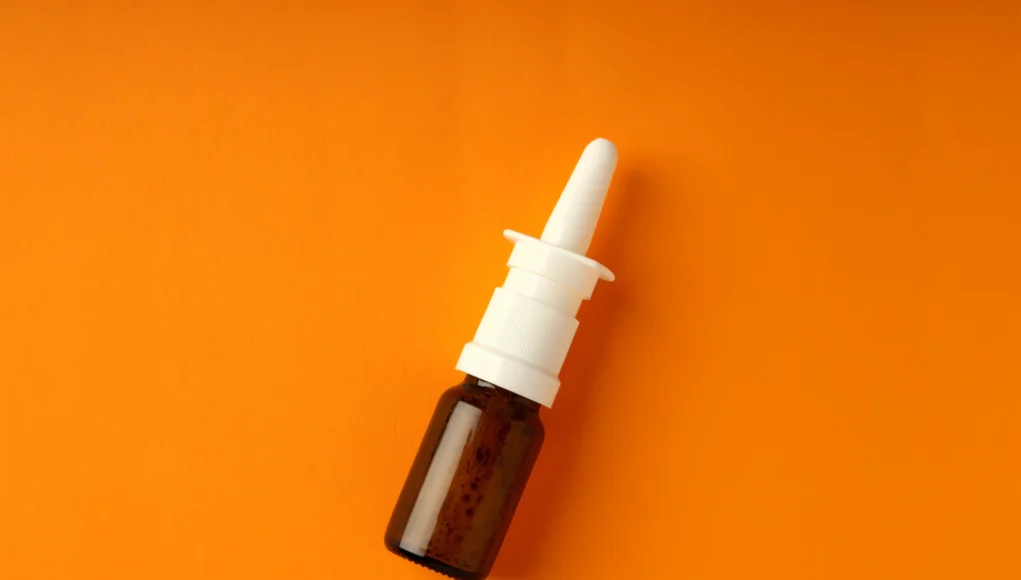
La Administración de Alimentos y Medicamentos de Estados Unidos (FDA) ha aprobado el primer diurético intranasal del país, marcando un hito en el tratamiento de pacientes con enfermedades cardíacas, hepáticas y renales. Esta innovación busca prevenir una complicación común y costosa que resulta en más de un millón de hospitalizaciones cada año.
Un spray revolucionario para un problema masivo
Enbumyst, un spray nasal de bumetanida desarrollado por Corstasis Therapeutics, se convierte en el primer diurético de asa intranasal autorizado para uso en Estados Unidos. Esta terapia está indicada para el tratamiento del edema asociado con insuficiencia cardíaca congestiva, enfermedades hepáticas y renales, incluyendo el síndrome nefrótico, en adultos.
El edema y la sobrecarga de líquidos representan una de las complicaciones más comunes y costosas de las enfermedades crónicas, generando más de un millón de ingresos hospitalarios anuales solo en Estados Unidos. Los diuréticos orales, ampliamente prescritos, pueden verse limitados por una absorción deficiente y un inicio retardado de acción, mientras que los diuréticos intravenosos requieren administración hospitalaria o en centros de infusión.
La innovación que cambia las reglas del juego
El nuevo spray nasal Enbumyst está diseñado para cerrar esta brecha terapéutica, ofreciendo a los pacientes una opción de autoadministración ambulatoria que reduce la dependencia del sistema hospitalario.
Resultados prometedores de los estudios clínicos
Los estudios clínicos realizados entre diciembre de 2023 y abril de 2024, que incluyeron a 68 adultos de entre 18 y 55 años, demostraron que el spray nasal logra:
- Absorción rápida y efecto diurético predecible
- Impactos comparables al bumetanida intravenoso
- Efectos similares en el volumen de orina, excreción de sodio y niveles de potasio
Esta terapia podría permitir una intervención más temprana fuera del hospital, reduciendo potencialmente las readmisiones y aliviando la carga financiera del sistema de salud.
Un cambio de paradigma para pacientes cardíacos
La terapia podría transformar el estándar de atención para pacientes con insuficiencia cardíaca en particular. Durante las fases de ensayos clínicos, el medicamento mostró un perfil robusto de seguridad y tolerabilidad. Los efectos secundarios más comunes reportados fueron:
- Hipovolemia
- Dolor de cabeza
- Calambres musculares
- Mareos
- Náuseas
Voces expertas respaldan la innovación
Ben Esque, Director Ejecutivo de Corstasis Therapeutics, declaró: «La aprobación de la FDA de Enbumyst representa un avance significativo en el tratamiento del edema para pacientes y proveedores».
Por su parte, la Dra. Anuradha Lala-Trindade, directora de investigación de insuficiencia cardíaca en el Mount Sinai Fuster Hospital de Nueva York, afirmó: «Ofrece el potencial de cambiar el estándar de atención al permitir una intervención ambulatoria más temprana. Esta innovación puede mejorar significativamente los resultados mientras potencialmente alivia la carga económica del sistema de salud».
Lanzamiento esperado para finales de 2025
Corstasis Therapeutics planea lanzar Enbumyst a finales de 2025, lo que representa una nueva era en el manejo ambulatorio de enfermedades que tradicionalmente han requerido hospitalizaciones frecuentes.
Esta aprobación marca un momento crucial en la medicina moderna, donde la tecnología de administración de medicamentos se encuentra con la necesidad urgente de descongestionar los sistemas hospitalarios, ofreciendo a millones de pacientes una alternativa más cómoda y eficaz para manejar sus condiciones crónicas.